Гидроксид натрия в быту. Что собой представляет
- Гидроксид натрия в быту. Что собой представляет
- Гидроксид кальция
- Гидроксид натрия. Химические свойства
- Гидроксид натрия применение в быту. Использование гидроксида натрия (NaOH) в быту
- Как получить гидроксид натрия в домашних условиях. Химические методы получения гидроксида натрия
- Гидроксид натрия, как определить. Гидроксид натрия: формула, уравнения реакций, свойства
- Видео каустическая сода / Едкий натр / Гидроокись натрия / Лучшее средство от засора
Гидроксид натрия в быту. Что собой представляет
Едкий натр – второе название каустической соды. Химическая формула вещества – NaOH (гидроксид натрия). Считается одной из сильнейших щелочей, способной разъедать органические вещества.
Благодаря этому свойству гидроксид натрия справляется даже с сильными загрязнениями, буквально «съедая» грязь биологического происхождения. Несмотря на то, что кожа человека – органическое вещество, каустик используют в косметологии в качестве основы для мыла. Именно каустическая сода дает мылкость, образует пену.
Отличие от других видов
С химической точки зрения каустик нельзя считать аналогом кальцинированной соды , которая также помогает справиться с загрязнениями, засорами, жирными пятнами в быту. Разница между каустической содой и кальцинированной содой, прежде всего, в происхождении веществ и химическом составе.
Кальцинированная сода – это обезвоженная соль угольной кислоты, карбонат натрия. Дома каустическую соду получают в результате реакции карбоната натрия с водой. Вторым продуктом реакции является гидрокарбонат натрия – пищевая сода. Каустик назван содой условно, так как не относится к солям, не содержит оксид углерода.
В отличие от своих «родственников», гидроксид натрия нельзя считать бытовым чистящим порошком универсального применения. Основные различия с кальцинированной и пищевой содой представлены в таблице.
Гидроксид кальция
Calcium hydroxideГидроксид кальция (пищевая добавка Е526) — химическое вещество с формулой Ca(OH)2. Внешне выглядит как сухой белый кристаллический порошок, склонный к комкованию.
Температура плавления — 512 °C, температура разложения — 520 °C; поглощает CO2из воздуха. Растворим в глицерине; средне растворим в воде ; нерастворим в этаноле . Водный раствор называется известковой водой, суспензия — известковым молоком.
В природе встречается в минерале портландит.
Пищевая добавка Е526 относится к отвердителям и регуляторам кислотности синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов.
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174–197 °C) водяным паром в автоклаве при повышенном давлении 9–15 атмосфер.
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Применение
Пищевая промышленность
В производстве сахара для обессахаривания патоки, для нейтрализации глицериновых вод, образующихся при гидролизе жиров (этот способ нейтрализации имеет ограниченное применение). Используют водную суспензию Ca(OH)2— известковое молоко — в количестве, обеспечивающем слабощелочную реакцию среды.
Другие сферы применения
Польза и вред
Научные данные о пользе применения пищевой добавки Е526 для здоровья человека в настоящий момент отсутствуют. Биологической ценности не представляет.
Относится к умеренно опасным веществам (3 класс).
При воздействии в концентрированном виде может провоцировать раздражение кожи и слизистых вплоть до химических ожогов, при действии на глаза и вдыхании — слепота и повреждения лёгких.
Хроническая токсичность остаётся нераспознанной: при длительном воздействии на организм отмечено медленное охрупчивание зубов.
Представляет угрозу для окружающей среды особенно для водотоков, водоёмов и водных экосистем.
Симптомы отравления
Чувство жжения; спазмы и боль в горле; снижение артериального давления; нарушение работы желудочно-кишечного тракта.
Первая помощь заключается в тщательном промывании поражённого участка водой. При проглатывании гидроксида кальция следует выпить стакан молока и немедленно вызвать врача.
Гидроксид натрия. Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2(едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
- c кислотами — с образованием солей и воды:
- NaOH + HCl → NaCl + H2O
Общая реакция в ионном виде:
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
- с амфотерными гидроксидами
- с солями в растворе
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- :
например, с фосфором — с образованием гипофосфита натрия:
с серой:
- с галогенами
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
Гидроксид натрия применение в быту. Использование гидроксида натрия (NaOH) в быту

Большинству обывателей гидроксид натрия известен, как каустическая сода. Многие слышали названия едкий натр, едкая щелочь, гидроокись натрия, все это имеет отношение к тому самому каустику, то есть каустической соде, без которой невозможно представить нашу сегодняшнюю жизнь.
Приготовление пищи
Одно из самых перспективных и древних направлений использования едкой щелочи – приготовление пищи. Если убрать едкий натр из кулинарии, человечество лишиться многих блюд, а в огромном количестве рецептов окажутся прорехи и никакие замены не вернут замечательный вкус яства, которые они приобретали благодаря каустику. Все мы ежедневно покупаем хлеб и мало кто задумывается о том, что во многом своими приятными свойствами он обязан каустической соде. Например, немецкие рогалики, знаменитые своей вкусной хрустящей корочкой, стали таковыми, так как перед выпечкой их опускают в раствор NaOH. Каустическая сода отлично размягчает маслины и придает им блестящий черный оттенок. Для того, чтобы приготовить Лютефиск – блюдо скандинавской кухни, засушенную треску пять дней надо вымачивать в едкой щелочи. Наличие каустической соды, как пищевой добавки, можно определить по обозначению Е525 на упаковке. Е525 добавляют в какао и карамель, мороженное и шоколад, эту отметку можно встретить на упаковках безалкогольных напитков.
Бытовая химия
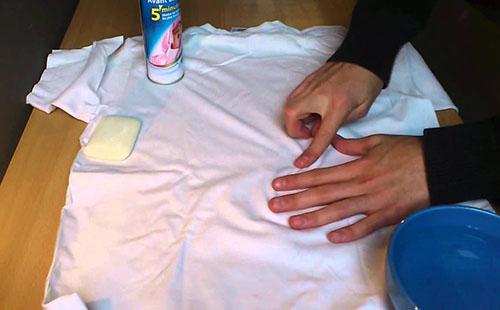
То, что каустическая сода способна омылять жиры заметили наши далекие предки. Хозяйки смекнули, что если в котел попала зола смешанная с жиром, котел будет значительно проще отмыть. Тем временем арабы еще в VII веке научились варить мыло, смешивая ароматические масла с каустиком. С тех пор за десять веков технология производства мыла практически не изменилась. Каустическая сода незаменима при производстве моющих средств. Ею мы моем посуду, тело и даже волосы. С помощью гидроксида натрия легко устраняются засоры в канализационных трубах.
Косметическое средство
Размягчающее свойство каустической соды незаменимо в косметологии. Ее наносят на ороговевшие участки пальцев вокруг ногтей, после чего старая кожа легко удаляется. С помощью NaOH также удаляют бородавки. Хорошо известный всем глицерин тоже содержит каустическую соду. И как бы далеко не продвинулась косметология, глицерин всегда востребован.
Ежедневно на каждом шагу мы встречаем NaOH, благодаря каустику наша жизни стала намного комфортнее и проще.
Как получить гидроксид натрия в домашних условиях. Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется множество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
Сегодня эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашенной известью при температуре около 80 °С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. После NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
- Na2СО3+ Fe2О3= 2NaFeО2+ СО2
- 2NaFeО2+ xH2О = 2NaOH + Fe2O3*xH2О
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. Помимо этого образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а после получают твёрдый продукт в виде гранул или хлопьев.
Гидроксид натрия, как определить. Гидроксид натрия: формула, уравнения реакций, свойства
 Гидроксид натрия, формула которого — NaOH, относится к разряду сильных щелочей, едких и опасных для человека, но несмотря на это, каждый человек встречается с гидроокисью натрия ежедневно. В косметических и фармацевтических средствах, в бытовой химии и даже в пищевых продуктах.
Гидроксид натрия, формула которого — NaOH, относится к разряду сильных щелочей, едких и опасных для человека, но несмотря на это, каждый человек встречается с гидроокисью натрия ежедневно. В косметических и фармацевтических средствах, в бытовой химии и даже в пищевых продуктах.
Свойства едкой щелочи
Гидроокись (гидроксид) натрия называют также едким натром, едкой щёлочью (такое название обусловлено способностью вещества разъедать стекло, кожу, бумагу, вызывать сильнейшие химические ожоги) и каустической содой (каустик — от греч. kaustikos жгучий, едкий).
Физические свойства
 Гидроксид натрия выпускается в виде гранул белого цвета, скользких на ощупь.
Гидроксид натрия выпускается в виде гранул белого цвета, скользких на ощупь.
Растворение вещества в воде, происходит с выделением большого количества тепла. Гидроксид натрия является гигроскопичным веществом, т. е. он активно поглощает водяные пары из воздуха. А также каустик способен поглощать углекислый газ, образуя на воздухе NaНCO3.
Молярная масса NaOH равна 39,997 г/моль, плотность вещества 2,02 г/см3, растворимость в воде 108,7 г/100 мл, температуры кипения и плавления для каустической соды равны соответственно 1403 °C и 323 °C.
Молекулы гидроокиси натрия полностью диссоциируют на ионы в водных растворах, а значит едкий натр — сильное основание. Водные растворы гидроокиси натрия обладают сильнейшей щелочной реакцией (pH 1%-раствора = 13).
Химические свойства
NaOH способен вступать в реакции с кислотами (серной H2SO4, угольной H2CO3, соляной HCl и другими), в результате чего образуются соли и вода:
- 2NaOH + H2CO3 → Na2СO3 + 2H2O,
- 2NaOH + H2SO4 → Na2SO4 + 2H2O.
С кислотными оксидами в результате взаимодействия образуются соль и вода:
- SiO2 + 2NaOH → Na2SiO3 + H2O,
- 2NaOH + SO2 → Na2SO3 + H2O.
C основными оксидами реакция не идёт: MgO/ Bao /CaO + NaOH ≠.
C амфотерными оксидами гидроксид натрия также образует соли и воду: ZnO + 2NaOH + H2O → Na2
C солями гидроокись натрия реагирует при условии, что в результате будет образовано нерастворимое как, например, в реакции с сульфатом меди (CuSO4 + NaOH), газообразное вещество или вода:
- Fe2 (SO4)3 + 6NaOH → 2Fe (OH)3↓ + 3Na2SO4,
- CuSO4 + 2NaOH → Cu (OH)2↓ + Na2SO4,
- CuCl2 + 2NaOH → Cu (OH)2↓ + 2NaCl.
C неметаллами:
- с фосфором 3NaOH + 4P + 3H2O → 3NaH2PO4 + PH3,
- с серой 6NaOH + 3S → 2Na2S + Na2SO3 + 3H2O.
C металлами гидроокись натрия реагирует с цинком (Zn), алюминием (Al), титаном (Ti). C железом же и медью NaOH не взаимодействует. Примеры:
- Zn + 2NaOH + 2H2O → H2↑ + Na2
тетрагидроксицинкат натрия, - 2NaOH + 2Al + 6H2O → 3H2↑ + 2Na
тетрагидроксиалюминат натрия.
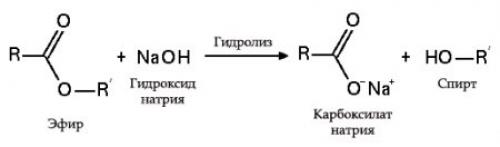
C жирами щёлочь реагирует с образованием мыла: (C17H35COO)3C3H5 + 3NaOH → C3H5 (OH)3 + 3C17H35COONa.
Методы получения вещества
Промышленные методы, с помощью которых можно получить едкий натр, делятся на химические и электрохимические.
Химические методы
Существует три основных химических метода.
Пиролитический метод состоит из двух стадий:
- Получение оксида натрия, разложением карбоната или гидрокарбоната при температуре: Na2CO3 = Na2O + CO2 или NaНCO3 = Na2O + 2CO2↑ + Н2О — при 1000 °C.
- Получение непосредственно гидроокиси натрия, растворением оксида: Na2O + H2O = 2NaOH.
Известковый метод: взаимодействие карбоната натрия (соды) с гашёной известью (гидроксидом кальция) при температуре (80 °C) называют каустификацией. Результатом такой реакции является раствор каустической соды и осадок карбоната кальция.
Уравнение реакции: Na2CО3 + Са (ОН)2 = CaCО3 ↓ + 2NaOH .
Ферритный метод получения может происходить двумя способами:
- Спекание кальцинированной соды с оксидом железа (III) при температуре 1100−1200 °C с образованием феррита натрия: Na2CO3 + Fe2O3 = NaFeO2 + CO2↑.
- Получение гидроокиси натрия происходит с помощью «ощелачивания» (добавления воды) феррита: 2NaFeO2 + H2O = 2NaOH + Fe2O3*H2O↓.
Серьёзными недостатками таких способов является большой расход энергии и сильная загрязнённость продукта. Такие методы получения NaOH в настоящее время почти не используются в промышленности.
Электрохимические методы
Из минерала галита, состоящего преимущественно из NaCl, с помощью электролиза получают гидроксид натрия. Помимо щёлочи в результате такой реакции, получают ещё и хлор и водород.
Записать процесс можно уравнением: 2NaCl + 2H2O → H2↑ + Cl2↑ + 2NaOH.
В лабораторных условиях щёлочь можно получить, например:
- растворением оксида в воде Na2O + H2O = 2NaOH,
- реакцией перекиси натрия с водой Na2O2 + H2O = 2NaOH+Н2О2.
Но в настоящее время химические методы получения редко используются в лаборатории, чаще используют электрохимические методы.